Найден способ победить один из самых опасных видов рака. Как ученым удалось создать оружие против смертоносной опухоли?
Американские ученые разработали экспериментальный способ лечение рака поджелудочной железы

Американские инженеры-биомедики Университета Дьюка разработали наиболее эффективное лечение особо опасного рака поджелудочной железы, когда-либо испытанное на подопытных мышах. В отличие от других экспериментальных методов, которые приводили лишь к остановке роста опухолей, терапия с использованием биогеля, радионуклидов йода-131 и химиотерапии полностью устраняла злокачественные клетки у грызунов, в том числе в тех случаях, когда болезнь считается наиболее трудно поддающейся лечению. Однако еще предстоит провести множество исследований, прежде чем новый метод можно будет применить на людях.
Рак поджелудочной железы входит в тройку самых смертоносных опухолей
В клинической онкологии рак поджелудочной железы считается самым смертоносным. Несмотря на то что он довольно редкий, и на его долю приходится всего 3,2 процента всех случаев рака, он является третьей среди ведущих причин смерти от рака. Злокачественные опухоли поджелудочной железы быстро развивают резистентность к традиционным методам лечения из-за сочетания уникальных факторов. Например, в клетках происходят генетические аберрации — хромосомные перестройки, — из-за которых опухоль приобретает устойчивость к химиотерапии и лучевой терапии. Кроме того, вокруг опухоли формируется область, обедненная кровеносными сосудами, которая является барьером для доставки лекарств.
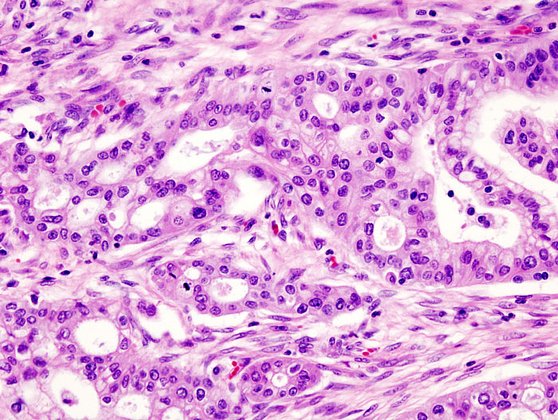
Новый метод основан на использовании радиоизлучения
Новый метод лечения, обозначенный в статье как I-ELP, является формой брахитерапии — варианта лучевой терапии, когда радиоактивный источник помещается внутрь самой опухоли. Это позволяет добиться того, что патогенные ткани получают максимально возможную дозу облучения. Однако до сих пор ни один из существующих методов брахитерапии не улучшил клинические результаты при раке поджелудочной железы, поскольку в них использовались источники гамма-излучения. Гамма-лучи выходят за пределы опухолевых тканей, что делает их опасными для здоровых органов, поэтому использовались только низкие и неэффективные дозы облучения. Чтобы решить эту проблему, ученые использовали сочетание радиоактивного йода с эластиноподобным полимером и наночастицами, связанными с химиотерапевтическим средством.
Радионуклиды йода-131 поместили в биогель
Эластиноподобный полимер (ELP), содержащий радионуклиды, при комнатной температуре находится в жидком состоянии, однако образует стабильное гелеобразное вещество в более теплом человеческом теле. При введении в опухоль полимер образует сгусток биогеля, заключающий в себе радиоактивные изотопы йода-131 и предотвращающий его утечку в организм. В отличие от других форм брахитерапии йод испускает не пронизывающее гамма-излучение, а бета-излучение, которое отдает всю энергию окружающим опухолевым тканям, не достигая здоровых тканей. Со временем полимер, который состоит из обычных аминокислот, распадается и поглощается организмом, а йод-131 распадается с образованием безвредного и инертного ксенона. Излучение стабилизирует биогель, поэтому последний разлагается не ранее, чем израсходуются радионуклиды.
В качестве дополнительного средства использовали препарат паклитаксел
Предыдущие эксперименты показали, что биогель с радиоактивным йодом сам по себе не приводит к уменьшению опухолей. В новом исследовании ученые проверили сочетание брахитерапии с химиотерапией, которое, согласно гипотезе, должно успешно противостоять механизмам резистентности, присущим раку поджелудочной железы. Для этой цели они использовали химиотерапевтическое средство паклитаксел, которое останавливает клеточный цикл раковых клеток и делает их особенно восприимчивыми к радиоизлучению. По задумке специалистов, оба типа лечения взаимодополняют друг друга: кроме того, что они препятствуют размножению клеток, бета-излучение изменяет микроокружение опухоли, способствуя накоплению паклитаксела.
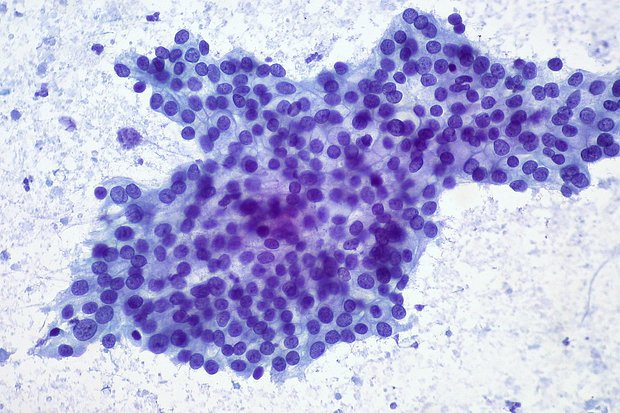
Лечение испытали на мышах с имплантированным человеческим раком
Метод был испытан на мышах с ксенотрансплантатами опухоли поджелудочной железы человека, которые вживляли прямо под кожу грызунов. Для эксперимента была выбрана линия раковых клеток BxPc3-luc2, для которой хорошо задокументирована резистентность к радиохимиотерапевтическим агентам. Эти клетки формируют опухоли с большой стромой, выполняющую поддерживающую и защитную роль, а также с дефицитом кровеносных сосудов, что объясняет их невосприимчивость к лечению. Опухоли выращивали внутри мышей до достижения размера 125 кубических миллиметров, после чего начинали лечение с различными дозами облучения и внутривенной инъекцией наночастиц с паклитакселом в дозе 25 миллиграмм на килограмм. Наилучший исход наблюдался при дозе облучения 10 микрокюри на кубический миллиметр: это была 100-процентная реакция на лечение с полным исчезновением всех опухолей через 14-21 день.
Радионуклиды и химиотерапия усилили друг друга
Интригующим открытием нового исследования стало то, что биополимер с радионуклидами йода разрушает барьеры микросреды раковой опухоли и улучшает ее проницаемость. Такие барьеры долгое время служили основным источником лекарственной устойчивости при раке поджелудочной железы, и преодоление этого препятствия было основным направлением клинических исследований. Бета-излучение усиливает молекулярную проницаемость внутри опухоли, увеличивая накопление паклитаксела. В свою очередь, паклитаксел повышает чувствительность опухолевой ткани к цитотоксическим эффектам радиации. Излучение уменьшает размер опухоли, еще сильнее увеличивая ее проницаемость.