Ученые раскрыли молекулярный механизм редкой генетической болезни
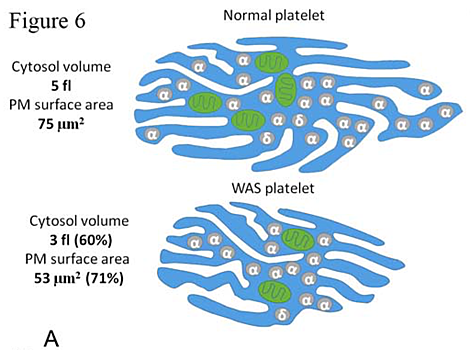
Коллектив российских ученых при ведущей роли сотрудников МГУ имени М.В. Ломоносова изучил молекулярные механизмы, происходящие в клетках крови у детей с синдромом Вискотта-Олдрича. Оказалось, что при этой болезни в тромбоцитах нарушается отношение объема клетки к площади её поверхности, что приводит к нарушению кальциевого гомеостаза и запуску редкого механизма программированной гибели клетки — митохондриального некроза. Коллектив российских ученых при ведущей роли сотрудников МГУ имени М.В. Ломоносова изучил молекулярные механизмы, происходящие в клетках крови у детей с синдромом Вискотта-Олдрича. Оказалось, что при этой болезни в тромбоцитах нарушается отношение объема клетки к площади её поверхности, что приводит к нарушению кальциевого гомеостаза и запуску редкого механизма программированной гибели клетки — митохондриального некроза. Работа была поддержана фондом «Врачи, инновации, наука – детям», Российским фондом фундаментальных исследований (РФФИ) и Российским научным фондом (РНФ). Результаты исследования опубликованы в журнале Haematologica. Синдром Вискотта-Олдрича — редкое генетическое заболевание, которое встречается в 1-10 случаях на 1 миллион человек по всему миру. Чаще оно проявляется у мужчин, поскольку вызвано мутациями гена WAS, находящимся в X-хромосоме. Этот ген кодирует белок WASP, который присутствует во всех типах клеток крови и отвечает за регуляцию актинового цитоскелета. Кровяные тельца с нарушенной работой белка WASP хуже распознают внешние факторы. Лейкоциты с поломкой в WASP не способны формировать адекватный иммунный ответ, а тромбоциты развиваются некорректно и склонны преждевременно умирать. Почему при синдроме Вискотта-Олдрича запускается каскад реакций, приводящих к гибели клетки, науке было неясно. Коллаборация российских ученых выяснила молекулярные механизмы, протекающие в нарушенных тромбоцитах. «В этой работе мы обнаружили механизм запрограммированной клеточной смерти тромбоцитов при синдроме Вискотта-Олдрича, наследственной болезни, при которой дети умирают от кровотечений,— рассказывает ведущий автор исследования, заведующий лабораторией клеточного гемостаза НМИЦ ДГОИ имени Дмитрия Рогачева и профессор кафедры медицинской физики физического факультета МГУ Михаил Пантелеев. — Этот механизм связан с нарушением соотношения объема/поверхность тромбоцита, которое ведет к нарушению кальциевого гомеостаза и гибели по пути митохондриального некроза». Ученые в реальном времени следили за уровнем ионов Ca2+ в цитоплазме нарушенных тромбоцитов, за электрическим потенциалом их мембраны и изменениями сигнальных молекул фосфатидилсерина на ней. В норме молекулы фосфатидилсерина располагаются на внутренней поверхности мембран, однако при запуске каскада реакций программируемой клеточной гибели они перемещаются на внешнюю. Оказалось, что уровень ионов кальция в поврежденных тромбоцитах в состоянии покоя значительно выше, чем у нормальных клеток, поляризация и реполяризация мембраны проходят значимо чаще, а их митохондрии чаще теряют мембранный потенциал вслед за экспозицией фосфатидилсерина после разрушения последней митохондрии. Микрофотографии тромбоцитов здоровых людей (А) и пациентов с синдромом Викскотта-Олдрича (В, С) в едином масштабе. Сканирующая электронная микроскопия S. Obydennyi, E. Artemenko, A. Sveshnikova, Mechanisms of increased mitochondria-dependent necrosis in Wiskott-Aldrich syndrome platelets. Haematologica. 2019. doi:10.3324/haematol.2018.214460 Запуск механизма программируемой клеточной гибели в нарушенных клетках ученым удалось предотвратить путем удаления излишков ионов кальция из клеточного окружения и введения внутрь клетки блокаторов пор митохондриальной мембраны: циклоспорина А или квестоспонгина C. Введение тапсигаргина — вещества, которое не дает клетке откачивать ионы кальция во внутриклеточные депо из цитоплазмы, — наоборот, приводило к скорейшей гибели клетки. Функционирование тромбоцитов также зависело от числа митохондрий в них: чем их меньше, тем скорее запускались механизмы апоптоза. На основе полученных данных ученые построили компьютерную модель. Модель показала, что «благополучие» тромбоцитов напрямую зависит от кальциевого гомеостаза: его нарушение приводит к экспонированию фосфатидилсерина на поверхность митохондриальной мембраны и гибели клетки по пути митохондриального некроза. Нарушение кальциевого гомеостаза, в свою очередь, происходит из-за нарушения соотношения площади поверхности к объему клетки. «Найденный механизм объясняет почему у детей с синдромом Вискотта-Олдрича мало тромбоцитов, что позволит предложить новые способы их лечения. Кроме того, эти данные проливают свет на механизмы клеточной смерти тромбоцитов даже в здоровых клетках, что пригодится при диагностике и лечении тромбозов и кровотечений»,— заключил Михаил Пантелеев. Заняться изучением синдрома Вискотта-Олдрича ученым предложили специалисты из Центра детской гематологии имени Дмитрия Рогачева, где лечатся дети с этим заболеванием, и они же предоставили генетически подтвержденные образцы крови пациентов с этим заболеванием. Помимо исследователей из МГУ имени М.В. Ломоносова и НМИЦ ДГОИ имени Дмитрия Рогачева, в работе приняли участие сотрудники Центра теоретических проблем физико-химической фармакологии РАН, Первого МГМУ имени И.М. Сеченова, Института эволюционной физиологии и биохимии имени И.М. Сеченова РАН, МГТУ имени Н.Э. Баумана и МФТИ. Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс.Новостей и читайте нас чаще. Пресс-релизы о научных исследованиях, информацию о последних вышедших научных статьях и анонсы конференций, а также данные о выигранных грантах и премиях присылайте на адрес science@indicator.ru.