Раскрыт механизм работы связанных с раком и аутизмом белков
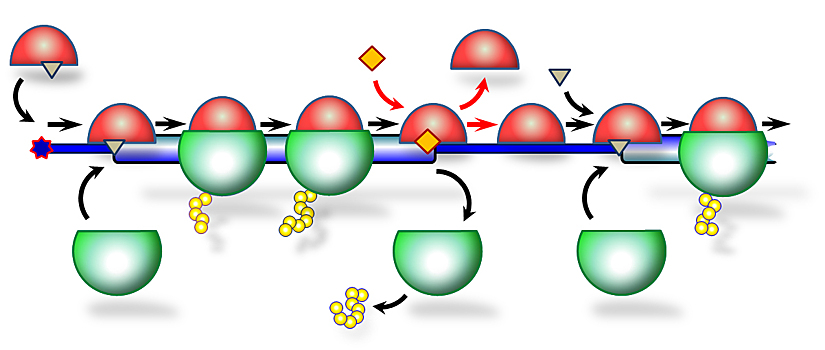
Ученые определили роль нового семейства белков, связанных с раком и аутизмом. Результаты работы опубликованы в высокорейтинговом журнале Molecular Cell. Исследование поддержано грантом Российского научного фонда (РНФ). Чтобы наш организм нормально работал, клетки должны постоянно производить новые белки, руководствуясь при этом заложенной в нас генетической программой. Белки – это цепочки аминокислот, которые синтезирует специальная молекулярная машина, рибосома. Последовательность аминокислот закодирована в матрице, которой служит молекула мРНК, а сам процесс синтеза-раскодирования называется трансляцией. Чтобы синтезировать правильный белок, рибосома должна связаться с матричной РНК (мРНК), найти правильное место для начала синтеза, затем «прочитать» всю кодирующую часть и освободить готовый белок. Все эти стадии трансляции изучены сейчас относительно неплохо, но вот что происходит с рибосомой после того, как она закончила свою работу, оставалось малопонятным. Чтобы выяснить это, ученые из США и России изучали семейство белков, в которое входят продукт онкогена (гена, который может стимулировать образование опухоли) MCT-1, его партнер DENR, связанный с аутизмом, и фактор трансляции eIF2D. «Фактор eIF2D был открыт нами еще в 2010 году, – рассказывает Сергей Дмитриев, старший научный сотрудник НИИ Физико-химической биологии им. А.Н. Белозерского МГУ и Института молекулярной биологии РАН. – Мы охарактеризовали его биохимическую активность, однако четкого понимания роли, которую играет этот белок в жизни клетки, у нас на тот момент не было. С тех пор появилось несколько очень сильных публикаций зарубежных коллег, из которых следовало, что eIF2D и два других похожих на него фактора, MCT-1 и DENR, могут быть задействованы в прочтении особого класса мРНК. У этих мРНК, помимо основной кодирующей части, в которой зашифрован главный белок, есть еще предшествующие ей короткие дополнительные рамки считывания – так называемые uORF». Такие uORF также может читать рибосома. Во многих случаях это мешает рибосоме попасть на главную кодирующую часть. Короткие uORF есть примерно в половине человеческих мРНК, поэтому было важно понять возможную роль eIF2D, MCT-1 и DENR в их трансляции. Однако определить точную функцию и разобраться в механизме работы этих факторов у человека ученые не могли. «Тогда мы обратились к более простым организмам – дрожжам, – говорит соавтор статьи Десислава Макеева. – Мы работали с дрожжевыми штаммами, у которых отсутствовали гены этих факторов. Наши партнеры из Национального института здоровья США применили к ним метод рибосомного профайлинга, позволяющий системно проанализировать трансляцию в мутантных клетках, а мы взяли на себя биохимическую часть». Метод рибосомного профайлинга основан на высокопроизводительном секвенировании (определении нуклеотидной последовательности) миллионов маленьких кусочков мРНК, покрытых читающими их рибосомами. Эта революционная техника позволяет увидеть полную картину биосинтеза белка, происходящего в клетке в какой-то интересующий нас момент времени. Иными словами, сделать как бы «фотоснимок» трансляции всех мРНК, которые читаются в тех или иных условиях, и для каждой определить интенсивность этого процесса. «В нашей лаборатории мы используем эту методику для изучения трансляции в клетках млекопитающих, – объясняет Сергей, – а наши американские коллеги применили ее к дрожжам. Однако данные, полученные с помощью таких системных подходов, надо непременно проверять классическими методами, чтобы избежать неверных интерпретаций. Для такой верификации мы использовали бесклеточные трансляционные системы – готовили экстракты клеток дрожжей, добавляли в них синтезированные в пробирке мРНК и наблюдали, сколько продукта синтезируется с них в случае дрожжевых штаммов с мутациями в том или ином гене». В результате этого сотрудничества ученым удалось выяснить, что факторы eIF2D, MCT-1 и DENR необходимы для своевременного отсоединения рибосомы от мРНК по окончании ее прочтения. А в тех случаях, когда мРНК содержит uORF, отсутствие факторов нарушает еще и трансляцию основной кодирующей части – ведет к увеличению производства главного белка. По-видимому, онкогенный потенциал MCT-1, а также нарушение процесса созревания нейронов при мутациях в гене DENR связаны именно с ролью этих факторов в трансляции uORF-содержащих мРНК, многие из которых кодируют важные регуляторы клеточных процессов. В исследовании приняли участие ученые из Национального института здоровья (США), Московского государственного университета им. М.В. Ломоносова, Института белка РАН и Института молекулярной биологии им. В.А. Энгельгардта РАН. Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс.Новостей и читайте нас чаще. Пресс-релизы о научных исследованиях, информацию о последних вышедших научных статьях и анонсы конференций, а также данные о выигранных грантах и премиях присылайте на адрес science@indicator.ru.