Помогают мыши, ламы и верблюды
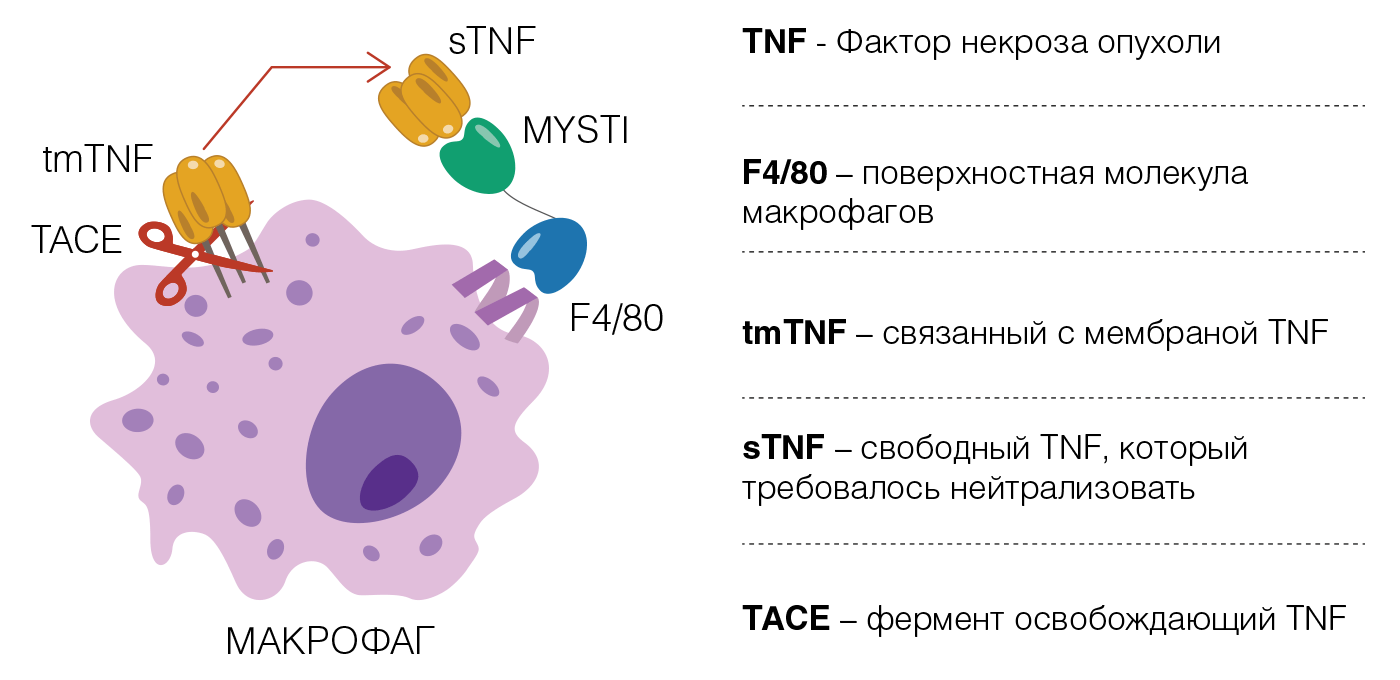
/ иммунобиотехнологии / Как победить аутоиммунные болезни Группа ученых Российской академии наук, Московского и Нижегородского университетов разрабатывает новые принципы антицитокиновой терапии для лечения аутоиммунных заболеваний Откуда берутся аутоиммунные заболевания Возможность аутоиммунитета - реакции на собственные белки и клетки организма - заложена в самом устройстве адаптивной ветви иммунной системы человека. Рецепторы лимфоцитов - Т- и В-клеток - формируются практически случайно, стохастически, что дает им принципиальную возможность распознать (и уничтожить) любое - как "чужое", так и "свое". Наш костный мозг ежеминутно генерирует огромное количество аутоиммунных (и тем самым очень опасных) лимфоцитов, но при этом в организме существуют хитроумные механизмы, позволяющие выбраковывать и уничтожать такие опасные клетки. Понятно, что умнее всего было бы такие опасные лимфоциты вообще не производить, но тогда нарушится принцип случайности. Но ведь именно этот принцип позволяет иммунной системе защитить нас от неизвестного патогена (например, от недавно завезенного из экзотической страны) и от постоянно возникающих трансформированных клеток, которые при некоторых сопутствующих обстоятельствах могут вызвать рак. Таким образом, центр тяжести переносится на механизмы контроля. А как мы знаем из повседневной жизни, нет такого механизма контроля, который хоть иногда не давал бы сбоя (возьмите ту же охрану аэропорта). И когда сбой произойдет, опасный лимфоцит (по сути - террорист) не будет вовремя обезврежен. В отличие от террориста, у лимфоцитов есть очень важное свойство - они способны размножаться делением: из одной опасной клетки может возникнуть миллиард идентичных опасных клеток. Таким образом, при нарушении механизмов контроля в организме человека могут возникать аутореактивные клоны лимфоцитов (как правило, речь идет о Т-лимфоцитах). Они начинают атаковать клетки собственных тканей и органов: поджелудочную железу, миелиновые оболочки нейронов, эпителиальные клетки кишечника и т. д. Известно, что в развитых странах растет число аутоиммунных заболеваний. Среди возможных объяснений - прогресс в санитарии и гигиене, чрезмерное воздействие на иммунную систему вакцинациями, изменение в стиле жизни, а также старение населения. Из-за индивидуальных особенностей иммунной системы разных пациентов аутореактивные клоны у них разные. Из этого следуют принципиальные трудности при создании универсальных терапевтических подходов, нацеленных на элиминацию таких клонов напрямую. Поэтому пока успеха в терапии некоторых аутоиммунных заболеваний удается достигать лишь воздействием именно на механизмы контроля. Продолжая аналогию с террористами, нельзя их всех уничтожить, но можно хотя бы поставить всякие кордоны и проверочные посты, которые не дадут им шанса добраться до жизненно важных объектов. Что такое цитокины Регуляция иммунной системы осуществляется на многих уровнях, один из которых - иммунорегуляторные цитокины. Цитокины - это белковые молекулы, с помощью которых клетки общаются друг с другом. Одна клетка произвела цитокин, а на поверхности другой клетки есть рецептор именно к этому цитокину. Рецептор связался с цитокином и передал внутрь второй клетки важный сигнал. То есть первая клетка с помощью цитокина послала инструкцию второй клетке. Если рецептора нет, или цитокина нет, то инструкция не будет получена, общение клеток не состоялось. Примерно двадцать лет назад была открыта роль небольшой группы цитокинов, ассоциированных с воспалением (их называют воспалительными, или провоспалительными), в контроле некоторых аутоиммунных заболеваний, в первую очередь ревматоидного артрита. К таким цитокинам относятся интерлейкин-1 (ИЛ-1), интерлейкин-6 (ИЛ-6) и белок со странным названием "фактор некроза опухолей" (это название историческое и мало что объясняет в нашей истории). Несмотря на то что эти цитокины могут посылать очень сходный сигнал принимающим клеткам, важное наблюдение ученых состояло в том, что если заблокировать сигнал только от одного конкретного цитокина, аутоиммунное заболевание либо не развивается, либо протекает в легкой форме. Здесь надо подчеркнуть, что все подобные исследования сначала проводят на лабораторных животных, в основном на мышах: именно у мышей ученые уже давно научились включать и выключать отдельные гены. Основы и реалии антицитокиновой терапии Итак, есть минимум три цитокина (на самом деле - намного больше), которые участвуют в иммунной регуляции, важной для контроля аутоиммунитета. Тот факт, что, заблокировав любой один из трех, можно достичь терапевтического эффекта, предполагает, что цитокиновые сигналы работают последовательно, как в цепочке, а не параллельно (тогда нехватка одного сигнала едва ли привела бы к значимому эффекту). Имея далеко не полную информацию, полученную на животных моделях, два английских ученых, Марк Фельдман и Равиндер Майни, рискнули начать клинические исследования по терапии ревматоидного артрита блокаторами фактора некроза опухолей (по-английски TNF, далее будем использовать эту общепринятую аббревиатуру). Интересно, что блокаторы TNF сначала хотели применять для предотвращения септического шока, но соответствующие клинические испытания провалились. Зато у некоторых пациентов с ревматоидным артритом блокировка TNF привела к значительному и длительному снижению симптомов болезни. Без преувеличения можно сказать, что этот вид очень специфической биологической терапии произвел революцию в ревматологии - даже при том, что на нее отвечали далеко не все больные. Впоследствии блокировка TNF стала успешно применяться при лечении воспалительных болезней кишечника (болезни Крона, язвенного колита), болезни Бехтерева, псориаза и некоторых других более редких заболеваний. Наступила эра высокоэффективной антицитокиновой терапии, одним из характерных признаков которой является тот немаловажный факт, что она не по карману простому смертному. Компании, производящие блокаторы TNF, кивают на дороговизну разработки, производства подобных лекарств и клинических испытаний. Объем годовых продаж только одного из пяти-шести блокаторов TNF - адалимумаба - превышает астрономическую сумму в 15 млрд долларов США. Даже в высокоразвитых странах с передовой медициной и хорошо отлаженной системой медицинского страхования такая терапия не может быть предложена всем тем, кто в ней нуждается. А у нас с этим совсем беда. Впрочем, у антицитокиновой терапии (а к ней добавились блокаторы ИЛ-1 и ИЛ-6) в ее современном виде есть очевидные недостатки и помимо дороговизны. Во-первых, не все больные на нее отвечают, и до сих пор нет надежных биомаркеров, которые позволили бы предсказать успех этой очень дорогой терапии. Во-вторых, природа-мать не для того отобрала в эволюции важные для нас гены и белки, чтобы можно было их беспрепятственно блокировать, даже при заболеваниях. Действительно, воспалительные цитокины призваны контролировать воспаление, а "хорошее воспаление" необходимо для борьбы с инфекциями. Тем самым, легко предсказуемый побочный эффект наиболее распространенной формы антицитокиновой терапии - ослабление инфекционного иммунитета. Конкретно для TNF известно, что он необходим для контроля инфекций, вызываемых микобактериями, и поэтому его блокировка может привести к активации "спящей" туберкулезной инфекции. Можно ли улучшить антицитокиновую терапию Во многих лабораториях давно размышляют о том, как сделать антицитокиновую терапию еще более специфичной. Если в ходе болезни сигналы от цитокина приводят к патологическим эффектам, то именно их и пытаются заблокировать лекарствами. Но у каждого цитокина есть важные полезные функции, которые желательно сохранить, хотя бы частично. Можно ли придумать способ блокировки только "вредной" активности, с учетом того, что "плохой" цитокин химически идентичен "хорошему" цитокину? Один новый подход был предложен группой российских ученых и основывался на более ранних результатах нашей лаборатории, показавших, что "плохие" и "хорошие" свойства TNF могут зависеть от того, какие клетки его произвели. Грубо говоря, миелоидные клетки (один из видов клеток иммунной системы) при артрите производят "патогенный" TNF, а некоторые другие клетки - полезный, защитный. На поверхности всех клеток есть молекулы, которые отличают один вид клеток от другого, это обстоятельство широко используется в цитометрии. Нами было создано искусственное биспецифическое антитело, которое одной своей "рукой" цеплялось за клетки, а другой - хватало производимой этой же клеткой цитокин - TNF (см. рис. 1). Биоинженерия антител - хорошо развитая область иммунобиотехнологии, причем здесь давно используют как совершенно искусственные структуры, так и белковые модули из необычных антител, которые есть у верблюдов и лам. Или у миног. Иными словами, инженерия биспецифических антител с заданными свойствами сейчас стала делом техники, главное - идея. А идея пришла из экспериментов с уникальными мышами, которые были специально сконструированы под эту проблему. Вообще-то генномодифицированную мышь, созданную для решения конкретной биомедицинской проблемы, можно рассматривать как уникальный прибор, созданный физиками для проведения каких-либо специальных измерений. Только в отличие от измерительного прибора мыши могут размножаться, поэтому такая ценная мышь может стать "хитом" и использоваться в десятках или даже сотнях лабораторий по всему миру. В тех, где нужно провести точно такое же "измерение". Итак, были созданы уникальные мыши (это заняло примерно пять лет), затем - уникальные биспецифические антитела (тоже пара лет работы) и затем был продемонстрирован принцип: возможность блокировки цитокина из конкретного клеточного источника. Важно подчеркнуть, что практически все эксперименты в работе Григория Ефимова и соавторов были проведены в России, а зарубежные соавторы предоставили важные биологические материалы, которые ускорили эту работу. Причем лет пять назад мы не смогли бы выполнить такой проект, так как у нас не было ключевого оборудования: нескольких довольно дорогих приборов. Они появились благодаря грантам Российского научного фонда, Министерства образования и науки, а также Программы перспективного развития МГУ. Создали ли мы лекарство от аутоиммунных заболеваний? Пока нет. Но мы показали, как это можно сделать. Именно в этом и состоит функция фундаментальной науки. Сергей Недоспасов, профессор, академик РАН, лауреат Государственной премии РФ в области науки и технологий, Институт молекулярной биологии им. Энгельгардта РАН, МГУ им. М. В. Ломоносова, ННГУ им. Н. И. Лобачевского