Препарат на основе мефлохина позволит восстановить синтез белка при наследственных заболеваниях

Некоторые наследственные заболевания человека сопровождаются мутациями, препятствующими синтезу белков в клетках. Ученые впервые установили, как совместное применение противомалярийного препарата мефлохина и аминогликозидных антибиотиков восстанавливает биосинтез белка в мутировавших клетках. Полученные данные потенциально позволят разработать лекарственные препараты, необходимые для пациентов, которые страдают от наследственных заболеваний, например мышечной дистрофии Дюшенна. Результаты исследования, поддержанного несколькими грантами Российского научного фонда (РНФ), опубликованы в журнале Proceedings of the National Academy of Sciences.
ДНК — это молекула, хранящая информацию о структуре всех белков в организме. Так, при синтезе определенного белка в клетке с фрагмента ДНК копируется молекула РНК. Образовавшуюся последовательность нуклеотидов, то есть структурных элементов РНК, считывает рибосома — молекулярный комплекс, синтезирующий белок. На каждую тройку нуклеотидов — кодон — рибосома добавляет одну аминокислоту, собирая их в цепочку, которая затем сворачивается в белок. При этом первый кодон, который считывает рибосома, называется стартовым, а последний, после которого синтез белка останавливается, — стоп-кодоном. При наследственных патологиях, таких как мышечная дистрофия Дюшенна, связанная с деградацией мышц, в ДНК возникает мутация, в результате которой в начале или середине последовательности РНК возникает лишний стоп-кодон. В результате рибосома, идущая по искаженной РНК, встречает его и преждевременно останавливает синтез белка. Из-за этого получается незаконченный, неработающий белок.
Чтобы рибосома не останавливалась на преждевременных стоп-кодонах и продолжала правильный синтез белка, потенциально можно использовать антибиотики аминогликозиды. Эти соединения усиливают взаимодействие рибосомы с молекулами, переносящими аминокислоты для будущего белка. Однако для получения значимого эффекта необходимы большие концентрации аминогликозидов, которые токсичны для клеток человека. Поэтому исследователи ищут способ уменьшить их побочные эффекты.
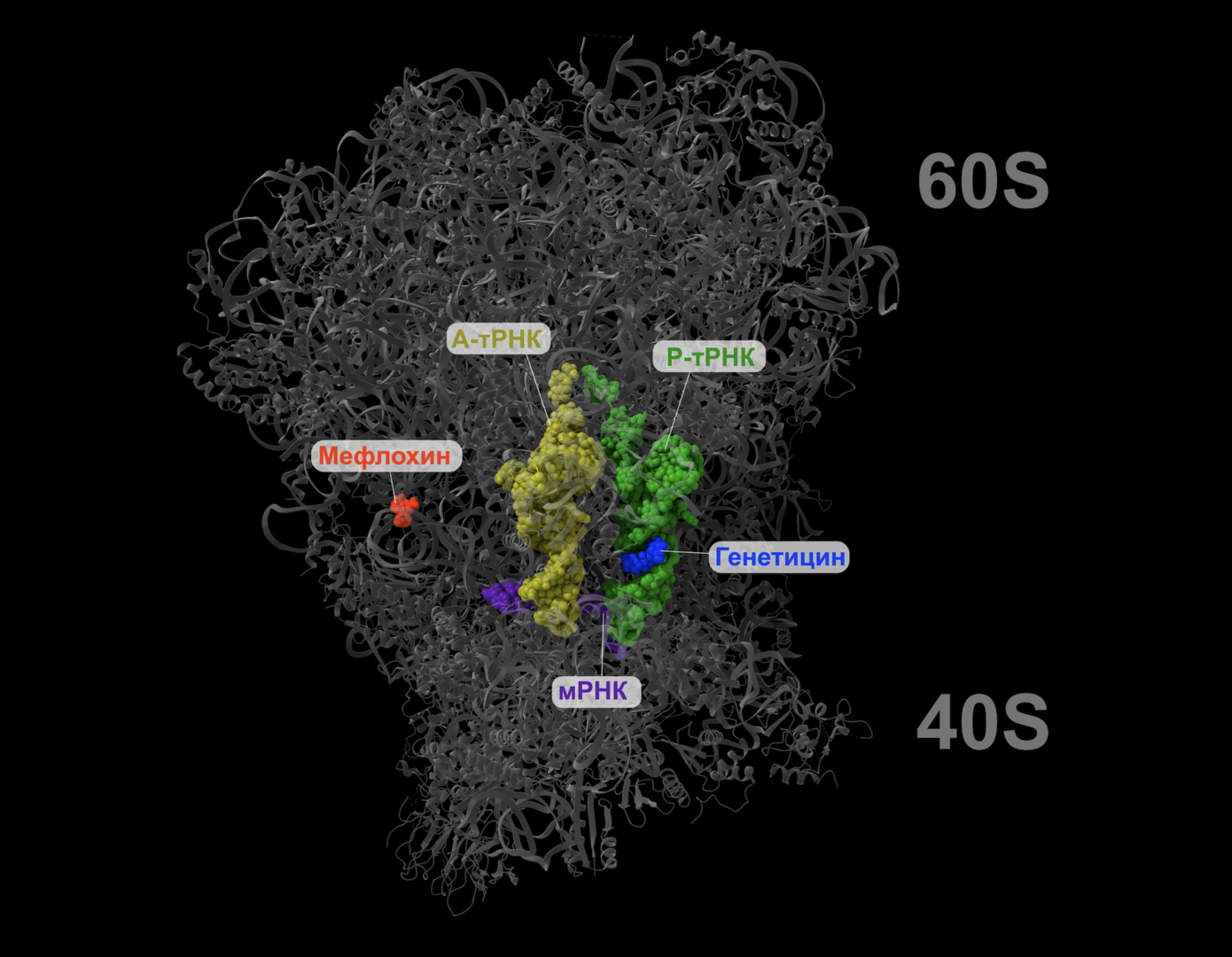
Ученые из Казанского (Приволжского) федерального университета (Казань) с коллегами исследовали, как противомалярийный препарат мефлохин влияет на работу аминогликозидов и взаимодействует с рибосомой. Авторы впервые определили, как меняется структура рибосом в клетках грибов в присутствии мефлохина и аминогликозидов. Для этого исследователи использовали криоэлектронную микроскопию — вариант электронной микроскопии, при котором образцы изучаются при низких температурах, — а также рентгеновскую кристаллографию. Это метод, который позволяет установить трехмерную структуру соединений по тому, как их кристаллы рассеивают рентгеновские лучи.
Оказалось, что мефлохин вызывает поворот фрагментов рибосомы относительно друг друга, тем самым усиливая действие аминогликозидов, что позволяет рибосоме «перешагнуть» через преждевременный стоп-кодон и продолжить синтез белка. Полученные данные позволят разработать лекарственные препараты, взаимодействующие с рибосомами и запускающие дальнейший синтез белка в клетках пациентов, которые страдают от наследственных заболеваний, связанных с нарушением синтеза белка.
«Мы разработали новый метод кристаллизации рибосом дрожжеподобных грибов Candida albicans, который позволяет увидеть малые молекулы в активных центрах рибосомы, что ранее было трудно осуществить методом криоэлектронной микроскопии. Добавив к ней данные рентгеновской кристаллографии, мы смогли увидеть в 3D с атомарным разрешением, как меняется структура рибосомы при связывании с различными молекулами. Мы с коллегами продолжаем изучать структуры рибосом из различных организмов, чтобы более полно понимать основы протекания биохимических процессов внутри клетки», — рассказывает участник проекта, поддержанного грантом РНФ, Константин Усачев, доктор физико-математических наук, профессор кафедры медицинской физики Казанского федерального университета.
В исследовании участвовали сотрудники Московского государственного университета имени М.В. Ломоносова(Москва), Московского физико-технического института (Москва), Объединенного института ядерных исследований (Дубна), Страсбургского университета (Франция) и Университета Гронингена (Нидерланды).